2023年10月,同济大学附属东方医院鲁兵团队在国际著名杂志Clinical and Translational Medicine(IF=10.6)在线发表题为“Loss of SETD2 aggravates colorectal cancer progression caused by SMAD4 deletion through the RAS/ERK signalling pathway”的研究论文。

该研究发现,SETD2通过调控DUSP7的表达水平抑制RAS/ERK信号通路,从而抑制SMAD4缺陷型结直肠癌的恶性进程。此结果解释了SETD2与TGF-β信号通路在晚期结直肠癌中的相关性,为中晚期结直肠癌的治疗提供了一个潜在的靶点。可以为与 SETD2和SMAD4突变相关的结直肠癌的药物研发提供重要的理论依据。
结直肠癌是一种遗传和表观遗传改变累积的多步骤疾病,也是最常见的恶性肿瘤之一。结直肠癌在全球范围内分布广泛,在男女性患者中发病率都排在第三位。结直肠癌早期缺乏特异性症状表现,往往难以引起病人的重视,在发现结直肠癌时往往已经到了中晚期,这给治疗带来了极大的挑战。基因突变是引起结直肠癌的主要因素之一,SMAD4在结直肠癌中有14%的突变率。目前已有研究表明,SMAD4作为TGF-β信号通路的核心转导分子,它的突变会影响TGF-β信号通路的转导并参与肿瘤的形成,SMAD4缺失的患者预后生存率更差。表观遗传改变也是影响结直肠癌的主要因素之一。SETD2作为表观遗传调控因子,可以催化组蛋白H3K36位点的三甲基化,从而调控其靶基因的转录。SETD2也是目前已知的唯一的H3K36三甲基转移酶。目前已有研究表明,SETD2可以通过调控氧化应激相关基因减轻实验性结肠炎。此外,SETD2在结直肠癌中有4%的突变率,这也表明SETD2在结直肠癌中的重要作用。但是,SETD2在TGF-β信号通路缺陷的结直肠癌中的具体机制目前尚不明确。
本研究通过多种研究方法,旨在研究SETD2在SMAD4突变结直肠癌中的作用和机制,以助于更好地了解结直肠癌的发生过程,并可能为结直肠癌治疗提供新的潜在靶点和药物治疗策略,为癌症治疗提供基础的理论研究。
为了探究SETD2在SMAD4缺陷结直肠癌中的作用,研究人员首先借助了TCGA数据库中的样本,分析SETD2与SMAD4的表达水平对于结直肠癌分期和生存率的影响,以及两者存在的相关性。其次,研究人员构建肠上皮特异性敲除SETD2和SMAD4的小鼠模型,通过AOM/DSS诱导结直肠癌,通过免疫组化,免疫印迹等方法进行表型分析。随后,研究人员通过RNA-seq和ChIP-seq生物信息学分析手段,寻找SETD2调控的靶基因,并通过免疫组化,免疫印迹等实验进行验证。最后,研究人员在动物水平上进行挽救实验,进一步确定SETD2调控SMAD4缺陷型结直肠癌的分子机制。
研究人员发现,SETD2和SMAD4在结直肠癌中的表达具有相关性,并且在中晚期结直肠癌患者中SETD2和SMAD4共突变率升高。Smad4 Vil-KO; Setd2 Vil-KO 小鼠在AOM/DSS诱导过程中出现更严重的结直肠癌表型,小鼠肠道肿瘤数量更多体积更大,分化程度更低,并且SETD2的缺失推动了SMAD4缺陷型结直肠癌的恶性程度。在进一步的机制探索中研究人员发现,SETD2的缺失可以直接下调DUSP7的表达而导致RAS/ERK信号通路的激活,从而加重SMAD4缺失型结直肠癌的恶性进展。而且,在Smad4 Vil-KO; Setd2 Vil-KO 小鼠体内抑制RAS/ERK信号通路可以显著抑制SMAD4缺失结直肠癌的发展。
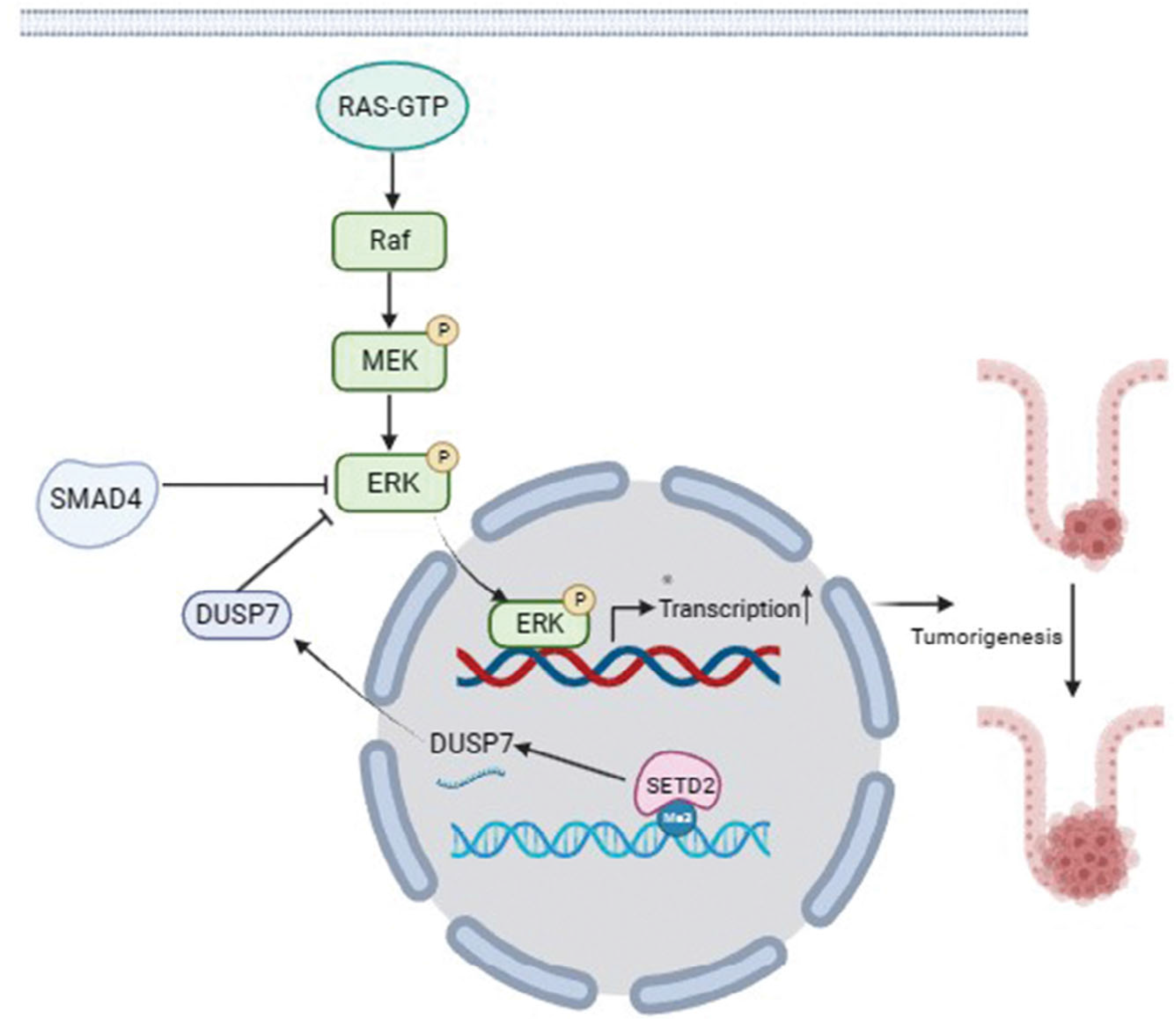
机制模式图
结论:该研究发现,SETD2通过调控DUSP7的表达水平抑制RAS/ERK信号通路,从而抑制SMAD4缺陷型结直肠癌的恶性进程。此结果解释了SETD2与TGF-β信号通路在晚期结直肠癌中的相关性,为中晚期结直肠癌的治疗提供了一个潜在的靶点。可以为与 SETD2和SMAD4突变相关的结直肠癌的药物研发提供重要的理论依据。
上海交通大学生物医学工程学院马春晓为本论文的第一作者,同济大学附属东方医院鲁兵与上海交通大学生物医学工程学院李力研究员为本论文的共同通讯作者。
