慢性肾脏病(CKD)全球患病率约为13.4%,肾纤维化是CKD患者的最终共同结局,目前临床尚无有效的治疗方法能够阻止CKD进展。
3月,我院肾内科刘娜教授研究团队在Advanced Science杂志(JCR Q1/中科院1区,IF 14.3)在线发表了题为“Autophagy Related 5 Promotes Mitochondrial Fission and Inflammation via HSP90-HIF-1α-Mediated Glycolysis in Kidney Fibrosis”的研究论文。该文第一作者是同济大学博士研究生胡艳,刘娜教授是此文的通讯作者。
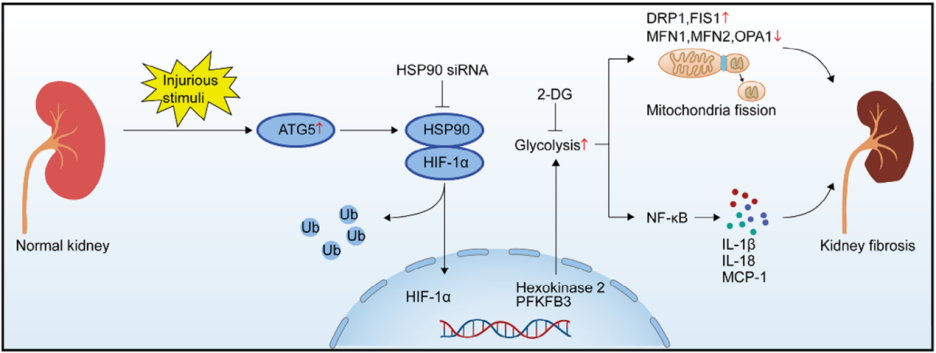
该研究探讨了自噬相关蛋白5(ATG5)在肾脏纤维化中的作用及其机制。研究发现,ATG5在尿酸(UA)、马兜铃酸(AA)和转化生长因子-β1(TGF-β1)诱导的人肾小管上皮细胞(HK-2)中显著上调,并且在慢性肾脏病(CKD)患者和多种肾脏纤维化小鼠模型(如高尿酸肾病HN、马兜铃酸肾病AAN和单侧肾缺血再灌注损伤uIRI)的肾脏组织中也明显高表达。通过肾小管条件性敲除ATG5,发现ATG5的缺失显著改善了肾脏纤维化,减轻了病理损伤,并改善了肾功能。
机制上,ATG5通过促进热休克蛋白90(HSP90)与缺氧诱导因子1α(HIF-1α)的结合,增强了HIF-1α的稳定性,进而促进了糖酵解的过度激活。异常的糖酵解进一步诱导线粒体分裂和炎症反应,即ATG5通过HSP90-HIF-1α介导的糖酵解途径,促进了线粒体分裂蛋白(如DRP1和FIS1)的表达,同时抑制了线粒体融合蛋白(如MFN1、MFN2和OPA1)的表达。此外,ATG5介导的糖酵解途径促进了NF-κB通路的激活和炎症因子(如IL-1β和IL-18)的表达,最终导致肾脏纤维化的发生。
研究还通过体外实验验证了ATG5在糖酵解中的作用。通过基因沉默ATG5,发现ATG5的缺失显著抑制了UA、AA和TGF-β1诱导的糖酵解,减少了乳酸生成和葡萄糖消耗,并抑制了糖酵解相关酶(如己糖激酶2和PFKFB3)的表达。此外,ATG5的缺失还显著改善了线粒体功能,减少了线粒体膜电位的去极化和线粒体损伤。
综上所述,这项研究揭示了ATG5在肾脏纤维化中的关键作用,表明ATG5通过HSP90-HIF-1α介导的糖酵解途径,促进了线粒体分裂和炎症反应,最终导致肾脏纤维化的发生。这些发现为开发针对肾脏纤维化的新型治疗策略提供了理论依据。(肾内科)