近日,同济大学附属东方医院南院肝胆胰外科陈波主任团队与再生研究生乐文俊研究员合作,在国际权威期刊《Cancer Letters》(中科院1区Top,2023年影响因子9.1)在线发表了题为《Neutrurin-induced activation of GFRA2-RET axis potentiates pancreatic cancer glycolysis via phosphorylated hexokinase 2》的研究论文。该研究首次揭示了胰腺癌神经浸润(PNI)通过分泌神经因子Neutrurin(NRTN)激活肿瘤细胞GFRA2-RET信号轴,进而磷酸化己糖激酶2(HK2)促进糖酵解的全新机制,为胰腺癌的靶向治疗提供了突破性策略。论文第一作者为崔然博士、刘富国医生,通讯作者为陈波主任医师、和乐文俊研究员。

胰腺癌:隐匿的“癌王”与神经浸润的致命关联
胰腺癌是消化系统恶性程度最高的肿瘤之一,早期症状隐匿,进展迅速,患者5年生存率不足10%。神经浸润(PNI)是胰腺癌的病理学特征,发生率高达70%以上,与疼痛、复发和不良预后密切相关。然而,PNI如何调控肿瘤代谢重编程的机制尚未阐明。陈波主任团队通过临床样本分析发现,高PNI的胰腺癌组织中糖酵解代谢产物显著富集,且患者预后更差。进一步的体外实验证实,背根神经节(DRG)与胰腺癌细胞的共培养可显著提升肿瘤细胞的葡萄糖摄取和乳酸生成能力。
神经-肿瘤对话:NRTN-GFRA2-RET轴驱动糖酵解风暴
研究团队通过质谱分析锁定神经细胞分泌的NRTN是关键效应分子。机制研究表明,NRTN通过结合胰腺癌细胞表面的GFRA2受体,招募RET激酶形成复合物,进而磷酸化HK2第122位丝氨酸(Ser122),显著增强其催化活性。这种磷酸化修饰使肿瘤细胞的糖酵解通量提升,为快速增殖提供能量和生物合成原料。动物实验进一步显示,阻断NRTN或抑制RET可显著延缓胰腺癌进展,联合治疗更展现出协同效应。
临床转化:从机制到治疗的跨越
该研究不仅揭示了PNI调控肿瘤代谢的分子开关,更提出了靶向干预新策略:
1.NRTN中和抗体:阻断神经-肿瘤旁分泌信号,抑制RET激活;
2.RET抑制剂:如已获批甲状腺癌的LOXO-292,可老药新用;
3.HK2抑制剂:针对磷酸化位点开发特异性抑制剂。
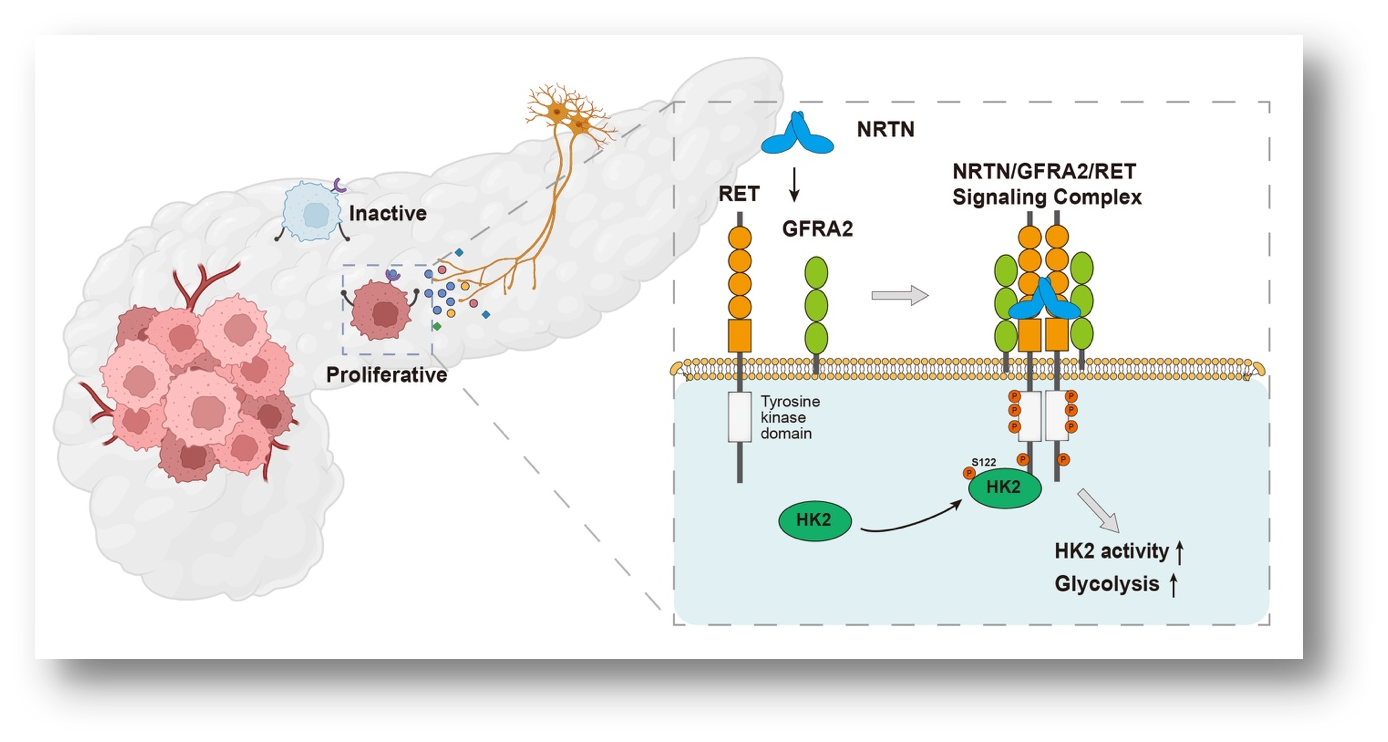
神经分泌Neurturin通过GFRA2/RET-HK2轴促进胰腺癌糖酵解的机制示意图
陈波主任表示:“这项研究为胰腺癌的神经依赖性进展提供了全新视角,未来我们期待联合核医学科开展NRTN分子影像诊断技术研发,从临床问题出发,通过基础研究揭示机制,最终反哺临床治疗,推动精准治疗方案的临床转化。”目前,团队已申请相关国家发明专利3项。
关于团队
同济大学附属东方医院肝胆胰外科是临床重点学科,近年来在胰腺癌肿瘤微环境与代谢调控领域连续取得突破性成果,先后在《Cancer Letters》、《Molecular Therapy-Nucleic Acids》、《Frontiers in immunology》等知名SCI期刊发表系列研究。本研究获国家自然科学基金、上海市科委“科技创新行动计划”、浦东新区卫生局“领先人才”培养计划等科研项目支持。
论文链接:[DOI:10.1016/j.canlet.2025.217583]
第一作者:崔然 主治医师 医学博士;刘富国 住院医师 硕士研究生
通讯作者:陈波 主任医师 医学博士 硕士研究生导师 ;乐文俊 副研究员 博士
