近日,我院脊柱外科贺石生教授、同济大学材料学院杜建忠教授团队,于Advanced Functional Materials杂志在线发表题为“Ultrasound-Propelled Antioxidant Nanobowls for the Treatment of Osteoarthritis”的研究论文。
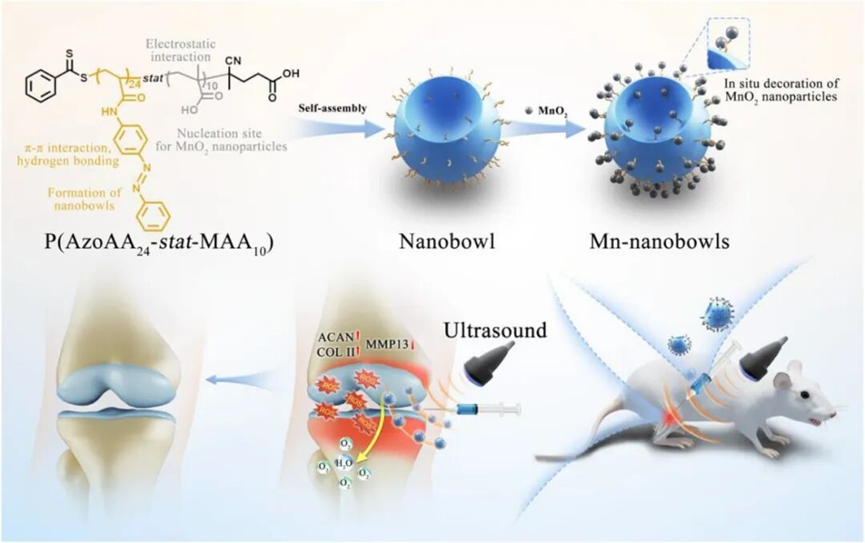
该研究通过两亲性共聚物P(AzoAA24-stat-MAA10)在π–π相互作用和氢键驱动下自组装形成,并在其表面原位沉积MnO₂纳米颗粒。其非对称结构使其在超声干预下可以穿透关节表面致密软骨膜达到软骨深部,此外MnO2的修饰不仅赋予纳米碗高效清除ROS的能力,还能同步产生氧气。
本研究提出了一种创新且极具前景的骨关节炎治疗策略:利用超声驱动的多功能纳米载体,兼具深层组织穿透能力与高效的ROS清除及供氧功能,为骨关节炎(OA)及其他深部炎症性疾病的精准治疗提供了新思路。

骨关节炎(OA)是一种致残性退行性关节疾病,其核心病理特征包括进行性软骨降解和活性氧(ROS)的异常累积。当前关节腔内治疗面临的主要挑战在于软骨致密且无血管的结构,严重限制了治疗药物在病灶部位的渗透与滞留,导致生物利用度低下、疗效不佳。为突破这一关键瓶颈,研究提出一种创新性治疗策略——开发超声驱动的抗氧化纳米碗。该系统可借助超声动力实现深层组织穿透,并精准靶向清除过量ROS,从而为骨关节炎的高效治疗开辟了一条极具前景的新路径。
材料设计与多功能集成创新
本研究首次将中空纳米碗结构与MnO₂纳米颗粒修饰相结合,通过精准调控两亲性嵌段共聚物 P(AzoAA-stat-MAA) 的 π–π 堆积与氢键相互作用,成功构建了一种具有不对称形貌的纳米载体。该设计不仅显著提升了纳米系统在致密软骨组织中的穿透能力,还借助 MnO₂的原位沉积,同步实现活性氧(ROS)清除与局部氧气生成,突破了传统单一功能纳米材料在骨关节炎治疗中的应用局限。
超声驱动与深层组织递送机制创新
研究团队创新性地引入外部超声场,实现对纳米碗的定向驱动与可控推进。体外实验中,该系统移动速度可达 40.35 μm/s;在体内关节环境中,成功穿透软骨达 307 微米深度。这一主动推进策略彻底摆脱了传统依赖被动扩散的递送模式,为克服无血管组织中药物渗透难这一长期瓶颈提供了全新技术路径。
仿酶催化与协同治疗效应
所构建的 MnO₂ 纳米碗展现出优异的类过氧化氢酶(CAT-mimetic)活性,在仅 5 μg/mL 的低浓度下即可分解约 25% 的 H₂O₂,催化效率与游离 MnO₂ 颗粒相当。该仿酶特性不仅高效清除病灶区过量ROS,同时持续释放氧气,有效缓解骨关节炎微环境中的缺氧状态,形成了“清除有害物质 + 生成有益因子”的双重协同治疗机制。
总体而言,团队构建了一种具有前景的抗炎治疗平台:在超声驱动下穿透致密软骨屏障,同步实现ROS清除与氧气释放。该策略不仅为OA治疗提供了新思路,更有望拓展应用于其他深部炎症性疾病,为提升临床治疗效率开辟了潜在路径。
同济大学附属东方医院为该文第一通讯单位,同济大学附属东方医院脊柱外科贺石生教授为通讯作者,杜建忠教授和李畅副研究员为共同通讯作者;龚浩宇博士为第一作者,张佳敏博士及樊云山主治医师为共同第一作者。(脊柱外科)
